Un neurotransmisor humano atrae a bacterias patógenas
- Investigadores del Departamento de Biotecnología y Protección Ambiental de la EEZ-CSIC han identificado y caracterizado un receptor bacteriano capaz de detectar acetilcolina. Esta molécula neurotransmisora humana funciona como atrayente para la bacteria Pseudomonas aeruginosa.
Las bacterias pueden desplazarse hacia nichos favorables o fuera del alcance de compuestos tóxicos para su supervivencia, mediante un proceso denominado quimiotaxis, en el que determinadas moléculas funcionan como atrayentes o repelentes. Numerosos estudios demuestran la importancia de este movimiento quimiotáctico para la supervivencia y los efectos, beneficiosos o perjudiciales, de las bacterias. Así, la quimiotaxis hacía las raíces de plantas es esencial para su colonización por bacterias beneficiosas, lo que a su vez puede favorecer el crecimiento de la planta o su resistencia frente a microorganismos patógenos. Sin embargo, también hay muchos casos en los que la quimiotaxis es necesaria para la virulencia de bacterias patógenas. En este trabajo se ha analizado la respuesta quimiotáctica de Pseudomonas aeruginosa, un patógeno oportunista capaz de infectar distintos organismos, incluyendo el ser humano. Los resultados muestran que P. aeruginosa está fuertemente atraída mediante la quimiotaxis a acetilcolina, uno de los principales neurotransmisores humanos.
El proceso de quimiotaxis se inicia con la unión de un compuesto, denominado quimioefector, a una proteína receptora. P. aeruginosa tiene 26 de estos receptores, de los cuales se conoce la función (el quimioefector reconocido) solamente para la mitad. En este trabajo se identifica el quimiorreceptor responsable de detectar la acetilcolina, denominado PctD, y se demuestra su capacidad de unión al neurotransmisor. PctD es el primer receptor bacteriano para acetilcolina descrito. En paralelo, se ha analizado un receptor similar a PctD en otra bacteria, que es incapaz de unir la acetilcolina. Mediante la resolución de las estructuras tridimensionales a alta resolución de los dominios de unión de PctD y de su homólogo incapaz de unir la acetilcolina, se han determinado las bases moleculares requeridas para la respuesta al neurotransmisor. Se puede utilizar dicha información para identificar receptores para acetilcolina en otras bacterias.
Este estudio expande el rango de moléculas de señalización importantes a la cuales las bacterias se acercan quimiotácticamente. Queda por demostrar en qué medida PctD puede estar implicado en la virulencia de P. aeruginosa. La interferencia con la función de receptores podría ser una importante estrategia alternativa a los antibióticos para combatir bacterias patógenas.
El trabajo, publicado en la revista mBio, es fruto de una colaboración con el Dr. José Antonio Gavira del Laboratorio de Estudios Cristalográficos de Granada y el Prof. Victor Sourjik del Instituto Max Planck para la Microbiología Terrestre en Marburgo (Alemania).
Matilla, M.A., Velando, F., Tajuelo, A., Martín-Mora, D., Xu, W., Sourjik, V., José A. Gavira, J.A. y Krell, T. (2022) Chemotaxis of the human pathogen Pseudomonas aeruginosa to the neurotransmitter acetylcholine. mBio 13: e0345821.

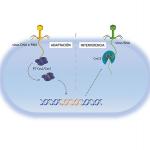
Estructura tridimensional a alta resolución del dominio de unión de quimioefectores del receptor PctD unido a acetilcolina, y los detalles moleculares del reconocimiento de acetilcolina. La grafica muestra la magnitud de respuesta en función de la concentración de quimioefectores.
Contacto: Unidad de Cultura Científica. EEZ-CSIC manuel.espinosa@eez.csic.es
Tino Krell tino.krell@eez.csic.es
Miguel A. Matilla miguel.matilla@eez.csic.es
Jose Antonio Gavira jgavira@iact.ugr-csic.es
Twitter: @KrellLaboratory; @gavirius; @miguel_matilla